O nome químico da água é óxido de hidrogênio e o seu símbolo H2O é tão comum que tornou-se sinônimo da substância água. A molécula da água é formada por dois átomos de hidrogênio, com carga positiva (H+), ligados a um átomo de oxigênio, com duas cargas negativas (O-2). Assim, o número 2 na fórmula da água indica que para cada dois hidrogênios existe um oxigênio. Portanto, a água é uma ligação entre três átomos: dois átomos de hidrogênio carregados positivamente (+) e um átomo de oxigênio carregado negativamente (-). Isso também pode ser representado da seguinte forma: HOH. Essa composição química é válida para qualquer estado da água, seja líquido, sólido (gelo) ou gasoso (vapor d'água).
Esses elementos estão ligados por meio de ligações covalentes, isto é, os átomos dos elementos químicos envolvidos compartilham seus elétrons da camada de valência a fim de obedecerem a regra do octeto e atingir a configuração geométrica e eletrônica mais estável possível. (Figura 1).

O ângulo de ligação é de 104,45º em função do par de elétrons isolados e não compartilhados do elemento oxigênio, fazendo com que a molécula de água tenha uma estrutura geométrica angular (Bent) (Figura 2).

A água pode parecer uma substância comum, mas ela tem propriedades que nenhuma outra substância possui. É conhecida como o solvente universal, pois é capaz de dissolver um grande número de substâncias, mais do que qualquer outro líquido, por causa de sua composição química e de seus atributos físicos. Isso significa que onde quer que circule, no ar, na terra, ou nos seres vivos, transporta substâncias importantes e fundamentais à vida, como minerais e nutrientes. O arranjo polar dos átomos de oxigênio e hidrogênio faz com que a molécula de água seja atraída por diferentes tipos de outras moléculas podendo, por exemplo, dissolver o sal (NaCl), quebrando as forças de atração que mantêm o sódio e o cloro juntos. O sal é dissolvido porque as ligações covalentes da água são mais fortes que as ligações iônicas existentes em suas moléculas (Figura 3).

Em geral, substâncias iônicas e polares, como ácidos, álcoois e sais, são relativamente solúveis em água, já as substâncias apolares, como gorduras e óleos, não são solúveis em água.
Propriedades da água de acordo com o estado físico
A água e toda a matéria apresentam três estados físicos: sólido, líquido e gasoso. A diferença está no quanto as moléculas estão próximas umas das outras. Isso acontece devido às forças de atração, onde as moléculas se aproximam umas das outras, e as forças de repulsão, quando as moléculas se afastam umas das outras.
Nas condições ambientais de temperatura e pressão dominantes no planeta, a água está em equilíbrio dinâmico entre os estados líquido, sólido e gasoso. É a única substância pura, encontrada naturalmente na Terra, com essa característica.
Sólido
Em condições normais de temperatura e pressão, quando a temperatura alcança 0°C, a água congela e fica no estado sólido (Figura 4). Quando congela, as moléculas se organizam em uma estrutura cristalina que as separa mais do que quando está em estado líquido. Ao contrário dos outros elementos, quando congelada, a água dilata, aumentando de volume, devido às alterações de sua configuração geométrica. Como resultado, o gelo flutua, porque é menos denso que a água líquida.

Essa expansão explica por que as garrafas ou as latas com líquidos quebram ou estufam quando congeladas (Figura 5).

Ao ser resfriada, a água assume uma configuração de rede cristalina que altera as componentes rotacionais e vibracionais das ligações, fazendo que a densidade seja reduzida e o gelo seja formado. Isso é bem interessante, pois a forma sólida da maioria das substâncias é mais densa que a fase líquida. Na maioria das substâncias, um bloco dessa substância sólida pura afunda num recipiente cheio da mesma substância líquida pura, mas na água ocorre o contrário, um bloco de gelo flutua num recipiente com água, porque a água sólida (gelo) é menos densa que a água líquida. Isso ocorre porque o gelo tem uma estrutura muito diferente da existente na água líquida, já que as moléculas se alinham numa rede regular, em vez de aleatoriamente (ao acaso) como na forma líquida. A disposição da estrutura do gelo permite que moléculas de água estejam mais dispersas do que num líquido, e, assim, o gelo é menos denso (Figura 6).

Quando a água congela, sua densidade decresce cerca de 9%, embora possa variar, pois o gelo pode conter ar (menos denso). A densidade do gelo é cerca de 90% da água líquida, por esse motivo cerca de 10% de um cubo de gelo ou de um iceberg, por exemplo, está acima da linha de água (aplicação do princípio de Arquimedes).
Líquido
A água em condições normais de pressão e temperatura é um líquido. Isso ocorre porque no estado líquido a energia da configuração geométrica/eletrônica é mais baixa, e, portanto, mais estável (Figura 7).

Na tabela periódica, o oxigênio só é menos eletronegativo que o flúor. Entende-se por eletronegatividade o poder de retenção de um átomo sobre um par eletrônico de ligação. Na geometria da molécula de água, o oxigênio exerce essa propriedade sobre os dois átomos de hidrogênio. Como a carga elétrica no eixo de ligação de cada átomo de hidrogênio está deslocada na direção do oxigênio, tem-se uma carga total (momento de dipolo elétrico) apontada vetorialmente na direção do oxigênio. Essa configuração torna a molécula de água polar, que, em geral, possui ligações intermoleculares/iônicas mais fortes, tornando maiores os pontos de fusão e ebulição.
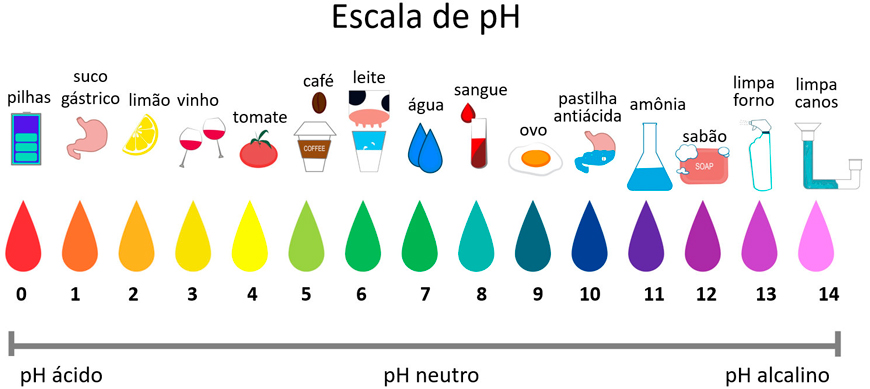
A água de acordo com sua concentração de íons hidrogênios pode apresentar índices de acidez (grande concentração de íon hidrogênio) ou alcalinidade (pequena concentração de íons hidrogênio). Essa escala é medida em termos de potencial hidrogeniônico ou pH, que é definido como –log [H+]. Para uma água neutra tem-se pH= 7, para ácidas pH<7 e para alcalinas pH>7 (Figura 8).
Gasoso
As ligações de hidrogênio também são responsáveis por essa característica. Para evaporar a água, primeiramente, deve-se romper parte das ligações de hidrogênio e, posteriormente, dotar as moléculas de água de energia cinética suficiente para passar para a fase gasosa (Figura 9). Para evaporar 1 grama de água, são necessárias 540 calorias a uma temperatura de 20ºC.

Gás e vapor têm significados distintos na química e na engenharia química. No vapor, o gás é passível de condensação. Quando essa situação não ocorre – acima da temperatura crítica da água por maior que seja a pressão aplicada – o gás não condensa (BRASIL, 2004).
Quando o ar úmido é resfriado, ocorre um equilíbrio entre a pressão parcial do vapor d’água – que é a pressão exercida por um gás acima do seu líquido – e a pressão de vapor da água. Nessa condição, o vapor começará a condensar. Esse ponto é conhecido como ponto de orvalho do ar úmido (BRASIL, 2004). O processo inverso faz com que a neblina "desapareça" pela manhã.
As mudanças de estados físicos da água
Existem cinco processos de mudança de estados físicos da água: fusão, vaporização, solidificação, condensação e sublimação (e ressublimação) (Figura 10).
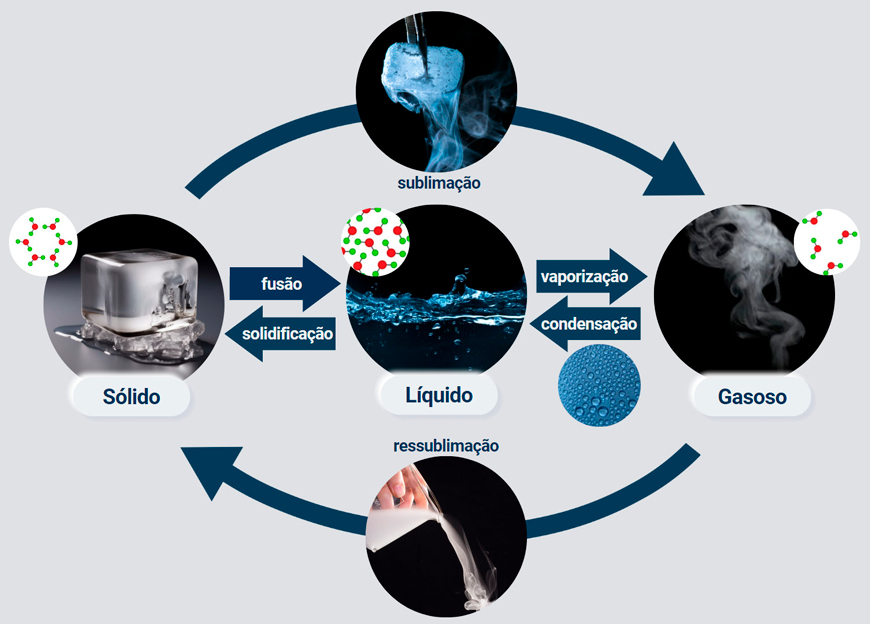
Fusão
Consiste na passagem do estado sólido para o estado líquido. Essa mudança pode ocorrer em um material (neste caso a água) por mudanças de temperatura e/ou pressão. Um exemplo é quando um gelo derrete durante um dia quente. Recebe o nome de ponto de fusão (PF) a temperatura em que a água passa do estado sólido para o estado líquido em determinada pressão. No caso da água, o ponto de fusão sob pressão atmosférica (101,3 kPa) é de 0° C.
Vaporização
Consiste na passagem do estado líquido para o estado gasoso através de mudanças de temperatura e/ou pressão. Recebe o nome de ponto de ebulição a temperatura em que a substância passa do estado líquido para o estado gasoso em determinada pressão. O ponto de ebulição da água sob pressão atmosférica é 100°C.
É importante lembrar que ebulição e evaporação são, na verdade, tipos de vaporização. A diferença entre as duas está na velocidade do aquecimento. Quando o aquecimento é lento, o processo chama-se evaporação.
Solidificação
Consiste no processo de mudança do estado líquido para o estado sólido causado pelo arrefecimento ou resfriamento. Recebe o nome de ponto de solidificação a temperatura em que a substância se torna sólida sob determinada pressão.
Condensação
É o processo em que há mudança do estado gasoso para o estado líquido devido ao resfriamento (arrefecimento). Exemplo: condensação do vapor d’água nos vidros do banheiro quando tomamos banho quente.
Sublimação
Consiste na passagem do estado sólido para o estado gasoso ou, ainda a passagem do estado gasoso para o estado sólido (ressublimação) através de arrefecimento. Dentre os exemplos, estão a naftalina e o gelo seco (Figura 11).

Cabe lembrar que o gelo seco não é gelo, mas gás carbônico ou dióxido de carbono (CO2) no estado sólido. Para que o CO2 fique no estado sólido, é necessário resfriá-lo a uma temperatura inferior a -78 °C, que é o seu ponto de congelamento. Quando exposto à temperatura e à pressão ambientes, o CO2 sólido sublima, passando do estado sólido ao gasoso, sem derretimento.
Referências
BRASIL, Nilo Índio do. Introdução à Engenharia Química. 2 ed., Rio de Janeiro: Interciência; PETROBRAS, 2004.
HEXAG EDUCAÇÃO. Quais são os quatro estados da água? ? [2020?]. Disponível em: https://cursinhoparamedicina.com.br/blog/fisica/quais-sao-os-4-estados-da-agua/. Acesso em: 16 maio 2022.
LIGAÇÃO covalente. [2022]. Disponível em: https://www.manualdaquimica.com/quimica-geral/ligacao-covalente.htm#:~:text=A%20liga%C3%A7%C3%A3o%20covalente%20%C3%A9%20aquela,a%20fim%20de%20ficarem%20est%C3%A1veis.&text=A%20liga%C3%A7%C3%A3o%20covalente%20%C3%A9%20um,a%20finalidade%20de%20ficarem%20est%C3%A1veis. Acesso em: 17 maio 2002.
LIMA, Júlio Cesar Lima. . Forças de Van der Waals.[2010?]. Disponível em: https://www.infoescola.com/quimica/forcas-de-van-der-waals/. Acesso em: 17 maio 2002.
MACEDO, Jorge Antônio Barros de. Águas & Águas. CRQ MG: [s. l], 2004.
MODELO de orbitais e distribuição. [2020?]. Disponível em: https://mundoeducacao.uol.com.br/quimica/modelo-orbitais-distribuicao-eletronica.htm. Acesso em: 16 maio 2022.